Характеристики Элементов Таблицы Менделеева
- Характеристика 17 Элемента Таблицы Менделеева
- Характеристика 20 Элемента Таблицы Менделеева
- Характеристика 15 Элемента Таблицы Менделеева
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. Менделеева и строению атома.
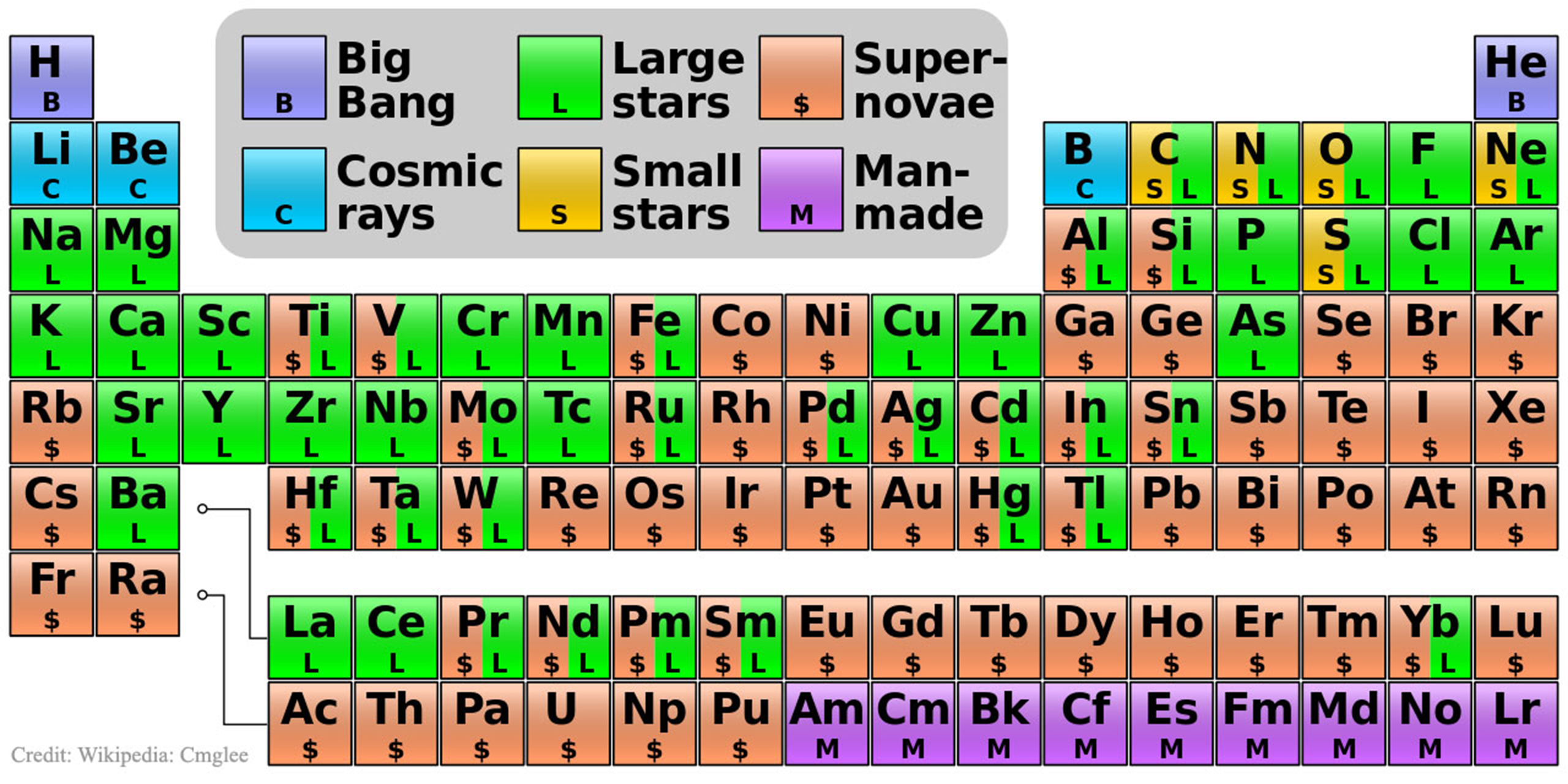
. /. /. Новости Периодической таблице Менделеева добавили элементов Четыре новых элемента – нихоний, московий, теннессин и оганесон – встали на свои места. В декабре 2015 года Международный союз теоретической и прикладной химии IUPAC (International Union of Pure and Applied Chemistry), что четыре новых элемента удовлетворяют критериям для включения в таблицу Менделеева: 113, 115, 117, 118.
Дело оставалось за малым: выбрать названия для новых элементов. В июне IUPAC предложил ориентировочные названия, и после обсуждений и голосования была наконец официально опубликована обновлённая версия таблицы Менделеева, в которой нихоний (113 Nh), московий (115 Mc), теннессин (117 Тs) и оганесон (118 Og) завершают 7-й ряд. Напомним, что каждый химический элемент характеризуется количеством протонов и нейтронов в ядре. Число протонов равно числу электронов, поскольку атом в целом электронейтрален, а вот количество нейтронов может меняться. Атомы с одинаковым количеством протонов, но разным количеством нейтронов (и, следовательно, разной ядерной массой), хотя и относятся к одному элементу, тем не менее, отличаются своими химическими и физическими свойствами – такие «вариации» называются изотопами.
Характеристика 17 Элемента Таблицы Менделеева
Элементы, чей номер в периодической таблице превышает 92, соответствующий урану, называют трансурановыми. Одна из их важнейших характеристик – период полураспада: время, после которого вероятность радиоактивного распада ядра составляет 50%. Все новые четыре элемента, как и большая часть сверхтяжёлых трансурановых элементов, слишком нестабильны, и поэтому в природе их не найти. Период полураспада в их ряду уменьшается от нескольких секунд до миллисекунд, и все они были получены за счёт ядерного синтеза, при котором ядра более лёгких элементов объединяются в одно массивное ядро. Итак, давайте познакомимся поближе с «новенькими» периодической таблицы, а заодно и выясним, как они получили свои названия. (Как известно, по правилам IUPAC название элемента должно происходить либо от мифического концепта или персонажа, либо от астрономических объектов, минералов или схожих субстанций, либо же из свойств самого элемента, от географических названий, или, наконец, от фамилий исследователей). Нихоний – элемент с неоднозначной историей.
Одними из первых его получили в лаборатории ядерных реакций им. Флёрова при Объединённом институте ядерных исследований (ОИЯИ) в Дубне, сотрудники которой вместе с коллегами из Ливерморской национальной лаборатории в Беркли опубликовали свои результаты в 2003 году; российские физики настаивали на том, чтобы новый элемент назывался беккерелиум. Тем не менее, эта публикация не убедила IUPAC, и пальма первенства досталась японским исследователям из Института физико-химических исследований (RIKEN), которые синтезировали 113-й элемент в 2004 году методом «холодного слияния». У такого способа синтеза очень низкая эффективность по сравнению с «горячим слиянием», которое использовали в Дубне и позже в Дармштадте: в первом случае получается три атома, во втором – нескольких десятков.
Но дело в том, что после «холодного слияния» нихоний распадается на известные изотопы, которые относительно легко охарактеризовать, тогда как после «горячего слияния» из нового элемента получились изотопы, до сих пор никому не известные. Так что в названии элемента приоритет отдали Японии: в переводе с японского Нихон означает «страна восходящего солнца», и нихоний стал в таблицу Менделеева первым словом с японским корнем.
Нихоний входит в группу бора, но ведёт себя скорее как переходный металл. Согласно расчётам, температура плавления и кипения нихония составляет 430°С и 1100°С, что делает его непохожим на «одногруппников», которые плавятся и кипят при существенно более низких температурах. Причиной тому служат релятивистские поправки к энергии электронов нихония, которые за счёт большой массы и размера ядра весьма существенны.
Период полураспада наиболее стабильного изотопа нихония Nh-286 составляет 20 секунд, и среди других изотопов элемента он настоящий долгожитель. Объяснить такой большой период полураспада можно тем, что ядра с определённым количеством протонов и нейтронов более устойчивы, чем другие. Согласно теории оболочечного строения атомного ядра, которую разработали Мария Гёпперт-Майер и Ханс Йенсен, количество нуклонов (протонов и нейтронов) влияет на энергию связи внутри ядра. У элементов, ядра которых состоят из 2, 8, 20, 28, 50, 82 и 126 нуклонов, заполнены все ядерные оболочки, и поэтому они более стабильны. Последовательность «2, 8, 20.» и т. Называется «магическими числами», что указывает на эмпирический характер теории.
Характеристика 20 Элемента Таблицы Менделеева
Она также предсказывает существование так называемого острова стабильности для трансурановых элементов. Для тех, кто оказывается в этом острове, характерен существенно больший период полураспада, чем у соседей по периодической таблице, и нихоний-286, видимо, сидит где-то неподалёку. Физики-ядерщики из ОИЯИ в Дубне в сотрудничестве всё с той же Ливерморской Национально Лабораторией синтезировали ещё один новый элемент – 115-й, названный московием. Существование московия экспериментально подтвердили лаборатории в Лундте и Дармштадте. На данный момент в общей сложности было получено около 100 его атомов. Московий чрезвычайно радиоактивен: его период полураспада составляет 220 миллисекунд.
Несмотря на близость к острову стабильности, известные на сегодня изотопы московия нестабильны. Впрочем, изотопы с большим количеством нейтронов распадаются медленнее, по-видимому, приближаясь к острову стабильности. Московий входит в группу пниктогенов (группа азота): ближайший к нему элемент той же группы – висмут. Московий предположительно является плотным металлом, вторым в группе после висмута. По физическим свойствам он напоминает нихоний, поскольку электроны московия также испытывают сильное спин-орбитальное взаимодействие.
По химическим свойствам московий скорее напоминают щелочной таллий. Теннессин – самый «молодой» элемент, полученный в 2010 году физиками из Дубны, Национальной Лабораторией Окридж и Ливерморской национальной лабораторией в США. На сегодняшний день было синтезировано 15 атомов теннессина, его период полураспада составляет 118 миллисекунд. Он принадлежит к галогенам, стоя в их группе сразу после йода и астата. Тем не менее, в его поведении преобладают металлические свойства.
Расчёты показывают, что температура плавления и кипения теннессина существенно ниже, чем у других элементов этой же группы – он должен кипеть около 210–350°С, поскольку, в отличие от других галогенов, способен существовать в одноатомной форме, без образования типичных для галогенов двухатомных молекул. Его история впечатляет: чтобы синтезировать теннессин, нужна мишень из берклиума-249, для которого, в свою очередь, нужен калифорний-252. И тот и другой очень сложно и дорого получить, поэтому физики ждали несколько лет, пока достаточное количество калифорния произведут в коммерческих целях, чтобы из остатков можно было получить берклиум. Период полураспада берклиума-249 – меньше года, и материал для эксперимента нужно было доставить из США в Подмосковье как можно скорее.
Характеристика 15 Элемента Таблицы Менделеева
Образец, защищённый несколькими слоями бетона (типичный способ защитить окружающую среду от радиации), прилетел в Москву, но из-за сложностей на таможне его не пропустили через границу, и за несколько следующих дней образец совершил несколько трансантлантических перелётов, пока его, наконец, не пропустили через российсскую границу. К счастью, берклиум попал в Дубну вовремя, и эксперимент по синтезу теннессина состоялся. Четвёртый элемент назван в честь Юрия Цолаковича Оганесяна – академика РАН, профессора ядерной физики и научного руководителя уже упоминавшейся Лаборатории ядерных реакций им. Флёрова в Объединённом институте ядерных исследований в Дубне. Это второй случай в истории, когда химический элемент назван в честь всё ещё живущего исследователя – таким образом IUPAC отметил вклад Юрия Цолаковича в физику сверхтяжёлых ядер и в том числе в экспериментальное подтверждение существования острова стабильности. Юрий Цолакович разработал теорию «холодного слияния», и под его руководством были впервые синтезированы элементы с 100-го по 108-й, а потом и со 113-го по 118-й.
При его участии было спроектировано и построено несколько уникальных ускорителей тяжёлых ионов, и во многом благодаря ему ОИЯИ начал активно сотрудничать с другими исследовательскими центрами ядерной физики по всему миру. Существование оганесона предсказывал в 1922 году ещё Нильс Бор, один из отцов атомной физики и квантовой механики, но открыли новый элемент только в 2002 году. Это самый тяжёлый химический элемент с периодом полураспада, равным приблизительно одной миллисекунде. Окончание «-он» в названии указывает на принадлежность оганесона к группе благородных газов, однако сам он, согласно расчётам – вовсе не газ, а твёрдое вещество. Причиной тому служат релятивистские квантово-химические эффекты и спин-орбитальное взаимодействие. Предполагаемая температура кипения оганесона равна 80°С. Более того, оганесон, скорее всего, весьма активен химически, поскольку энергия связи электронов внешней оболочки с ядром не очень велика: сказывается размер атома.
Хотя заполнение периодической таблицы Менделеева является фундаментальной задачей, у этих исследований есть важные прикладные «последствия». Например, благодаря развитию ускорителей и лучшему пониманию ядерной физики возможны такие методы лечения рака, как радиотерапия. Application form для моряков на русском.
Впрочем, прагматика прагматикой, а пока мы просто поздравляем физиков из лаборатории ядерных реакций им. Флёрова и Юрия Цолаковича Оганесяна с тем, что их выдающиеся достижения помогли обновить таблицу Менделеева!
1.Название 2.Химический знак, относительная атомная масса (Ar) 3.Порядковый номер 4.Номер периода (большой 4-7 или малый 1-3) 5.Номер группы, подгруппа (главная «А» или побочная «Б») 6.Состав атома: число электронов, число протонов, число нейтронов Подсказка! Число электронов = числу протонов = порядковому номеру; Число нейтронов = атомная масса ( Ar из таблицы Менделеева) – число протонов. Вид элемента (s, p, d, f) Подсказка! S -элементы: это первые два элемента в 1-7 периодах; p -элементы: последние шесть элементов1-6 периодов; d -элементы: это элементы больших периодов (по 10 штук) между s - и p -элементами; f -элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы. 8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня. Внешний уровень завершён у элементов VIII группы главной подгруппы 'А' - Ne, Ar, Kr, Xe, Rn. Для написания схемы нужно знать следующее: Заряд ядра атома = порядковому номеру атома; Число энергетических уровней определяют по номеру периода, в котором находится элемент; У s - и p -элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na +11) 2) 8) 1=номеру группы; У d - элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон). Например, Ti +22) 2) 8) 10) 2; Cr 24) 2) 8) 13) 1 – исключение Максимальное возможное число электронов на уровнях определяют по формуле N электронов = 2 n 2, где n – номер энергоуровня. Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV – 32 электрона и т.д. 9.Электронная и электронно-графическая формулы строения атома Подсказка!
Для написания электронной формулы используйте шкалу энергий: 1s.
Навигация
- Книгу Доцяк Українська Кухня
- Инструкция По Сборке Мебели Brw
- Отчет По Производственной Практике Дизайнера Пример
- Создание Фирменных Бланков
- Openstage 40T Инструкция
- Лексус Рх 350 Руководство По Эксплуатации
- Дт 75 Казахстан Инструкция
- Руководство Пользователя Pocketbook Touch Lux
- Инструкция Cisco Ip Phone 303
- Руководство По Эксплуатации И Ремонту Хайлендер
- Тест Для Официанта С Ответами
- Раскраска Состав Числа
- Голубина Чему Научит Клеточка
- Mini Kms Activator Office 2010
- Инструкция К Телефону Prestigio
- Препарат Окситоцин В Ветеринарии Инструкция
- Как Узнать Разрешение Pdf Документа
- Учебник Solutions Elementary 7 Класс